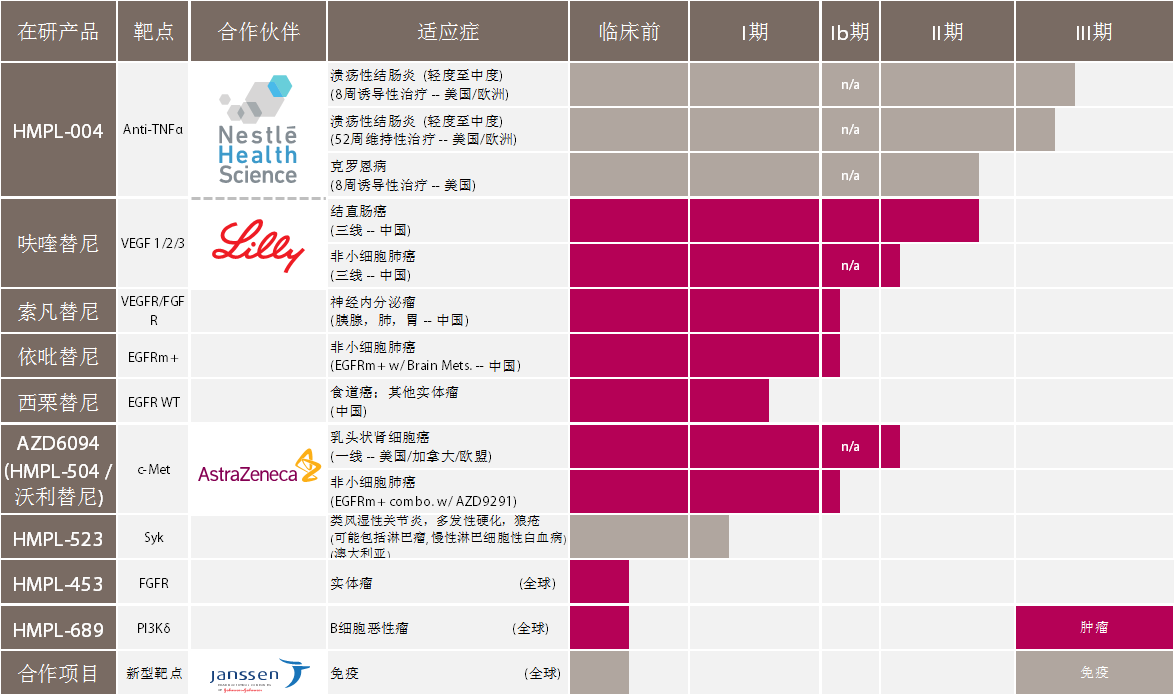
HMPL-004 是一种作用于多靶点的口服植物药,用于治疗自身免疫性肠道疾病。目前已完成三个临床试验,其中包括两个国际多中心临床二期试验。治疗溃疡性结肠炎的国际多中心IIb期试验入选受试者223名,成功达到预计目标,临床上减少肠道出血,粘膜修复效果明显并表现出良好的安全性。治疗克罗恩病的国际多中心II期临床试验入选受试者101名,试验结果呈现良好的疗效和安全性。治疗溃疡性结肠炎的三期临床试验于2013年初启动。. m' h. I" Z, R- d9 N+ w% k: A
: q9 I, P7 r! }5 F7 s' o. @7 K索凡替尼 (HMPL-012) 一种新型的以血管细胞内皮生长因子受体和成纤维细胞生长因子受体(VEGFR/FGFR)为双靶点的酪氨酸激酶抑制剂,能有效地抑制肿瘤血管生成。一期临床试验已在中国展开。初步研究结果表明受试患者对索凡替尼有良好的耐受性。主要适应症包括肝细胞癌(肝癌)、神经内分泌肿瘤、结直肠癌和乳腺癌。一期临床试验数据已于2014年6月在美国芝加哥举行的第50届美国临床肿瘤学会(ASCO)年会上公布。
, g" R( ~5 v+ z6 C, L; h. Q, h& j r; V7 E0 u
呋喹替尼 (HMPL-013) 是一种新型高选择性抑制血管细胞内皮生长因子受体(VEGFR1,2及3)的小分子化合物。在临床前研究中,呋喹替尼在数种实验动物肿瘤模型中表现出对肿瘤的强烈抑制效果。在临床一期试验中,呋喹替尼在晚期肿瘤患者中表现出良好的药代动力学特性和耐受性。一期临床试验数据已于2014年6月在美国芝加哥举行的第50届美国临床肿瘤学会(ASCO)年会上公布。主要适应症包括胃癌,结直肠癌和胰腺癌。
$ r& b ?" F9 m/ a4 ~" I8 K% \9 @3 N% R ?5 o
依吡替尼 (HMPL-813) 是一种新型的第二代口服小分子表皮生长因子受体(EGFR)抑制剂。该化合物显示出优异的组织分布,因而能够达到更广泛的抗癌活性。临床前期研究结果显示依吡替尼在脑部原发性肿瘤或脑转移肿瘤模型中具有极好的疗效以及良好的药代动力学特性和安全性。临床一期试验于2011年底在国内启动。0 _+ N- P# t" e/ v! R
2 E. \/ ] ?# D7 W2 P0 X2 l! T西栗替尼 (HMPL-309) 是一种全新选择性小分子表皮生长因子受体酪氨酸激酶抑制剂,有着独特的组织分布特性且能有效抑制耐药突变体。临床一期试验于2012年底在国内启动, 目前进展良好。主要适应症为非小细胞肺癌。
: G! s8 _: q' u3 i& c5 a3 g! F& U! z3 V" K( w4 J2 ?% T- p' ^
HMPL-504/AZD6094 (沃利替尼) 一种高选择性口服c-Met激酶抑制剂,它能有效抑制人体肿瘤模型中的肿瘤增殖,尤其是c-Met基因扩增及过表达的肿瘤。主要适应症包括肾癌、胃癌和非小细胞肺癌。c-Met基因扩增及高蛋白表达水平将做为筛选临床受试者的标准。一期临床试验数据已于2014年6月在美国芝加哥举行的第50届美国临床肿瘤学会(ASCO)年会上公布。
$ m$ b. x' h& `9 p
$ d) _# R! q( o# v选择性Syk抑制剂 (HMPL-523) 是针对B细胞受体信号通路中的酪氨酸激酶Syk的新型高选择性小分子抑制剂,是一种用于治疗类风湿关节炎和红斑狼疮等自身免疫疾病的口服制剂。在临床前研究中,HMPL-523显现出良好的药效和激酶选择性,在关节炎动物模型上,它能有效逆转关节炎症及骨侵蚀,减少多种促炎性细胞因子的生成,并在动物的毒理学研究中显示出良好的安全性。临床一期试验于2014年6月在澳大利亚启动。
6 e# o0 ^, w# [* Y* U' C1 {! I) v$ J0 c
选择性FGFR抑制剂 (HMPL-453) 是一种新型的高选择性小分子成纤维细胞生长因子受体(FGFR)抑制剂,目前处在临床前研究阶段。主要适应症包括小细胞肺癌,乳腺癌,多发性骨髓瘤,胃癌及膀胱癌。初步临床前研究结果显示HMPL-453具有良好的耐受性及药代动力学特性。1 t3 h4 D' O2 s/ _) W) g- _# |9 Z
; E# v: u3 D u8 f
|